《AM》:無創體內3D生物打印!用于骨折修復
時間:2024-01-31 09:37 來源:EFL生物3D打印與生物制造 作者:admin 閱讀:次
組織工程支架材料為患者的生理保護和治療提供了必要的支持。不幸的是,這種裝置的植入過程帶來了手術并發癥和感染的風險。因此,來自昆明理工大學的徐旭輝教授團隊和成都大學的余雪教授團隊合作開發了一種上轉換納米顆粒(UCNPs)輔助的生物3D打印方法,以實現無需侵入性手術的體內成型。合理設計的UCNPs將穿透皮膚組織的近紅外(NIR)光子轉化為藍紫光(300-500
nm),在體內誘導單體聚合固化過程,使用熔融沉積建模協調框架,精確預定的近紅外激光軌跡可以制造具有定制形狀的植入式醫療設備,成功實現了非侵入性骨折固定支架的3D生物打印證明,從而展示了一種全新的生物醫學治療體內成型方法。相關論文“Upconversion
3D Bioprinting for Noninvasive In Vivo
Molding”于2024年01月11日發表于雜志《Advanced Materials》上。
本文提出了一種基于UCNPS輔助聚合過程的非侵入性3D生物打印骨折固定系統,如圖1所示。采用3D坐標定位框架固定近紅外連續波(CW)激光器,并通過計算機輔助設計3D支架模型來精確控制NIR的移動。將含有UCNPs作為生物鏈接的單體溶液在體內非侵入性地打印成定制的形狀。
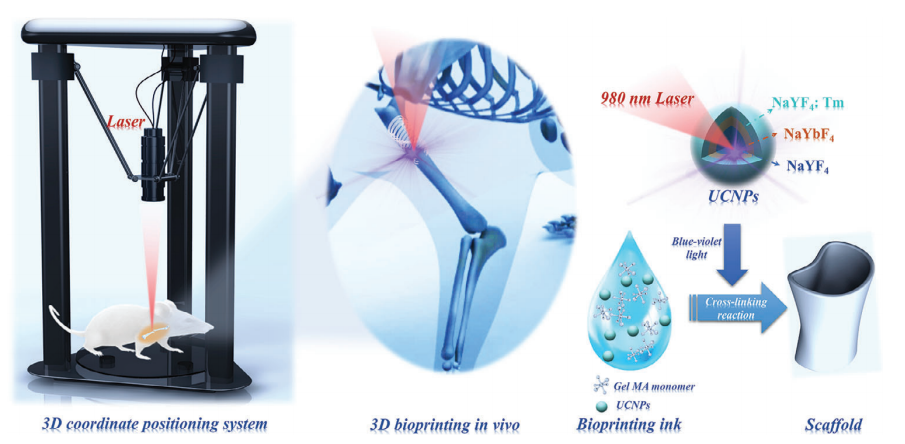
圖1 非侵入性固定斷骨的UCNPS輔助的3D生物打印體內示意圖
本研究中,設計了核殼NaYF4: Tm3+@NaYbF4@NaYF4來調制藍紫光發射,以實現高效的光聚合。本研究采用熱注射法逐層合成了一系Tm3+摻雜濃度為5%NaYF4: Tm3+@NaYF4@NaYF4 UCNPs(圖2)。核心材料(NaYF4:Tm3+)的代表性透射電鏡(TEM)圖像顯示單分散的六方顆粒,平均粒徑約為≈65 nm(圖2a)。利用透射電鏡(TEM)和高角度環形暗場掃描透射電鏡(HAADF-STEM)對合成的核-殼UCNPs的形貌進行了進一步評價。TEM圖像顯示,核殼粒子具有均勻分布和單分散性特征,其中中間的NaYF4(圖2b)和非活性的NaYF4(圖2d)的殼層厚度分別為9.28 nm和13.75 nm。此外,如圖2c、e所示的HRTEM圖像中,NaYF4: Tm3+@ NaYF4和NaYF4: Tm3+@ NaYF4@ NaYF4對應的快速傅里葉變換模式進一步表明所制備的UCNPs結晶良好。所得樣品的XRD譜圖及相應結構底部的模擬結果如圖2f所示。能量色散X射線(EDX)圖譜分析進一步證實了Na、Y、Yb、F和Tm的非均相核殼結構和均勻的元素分布(圖2g)。
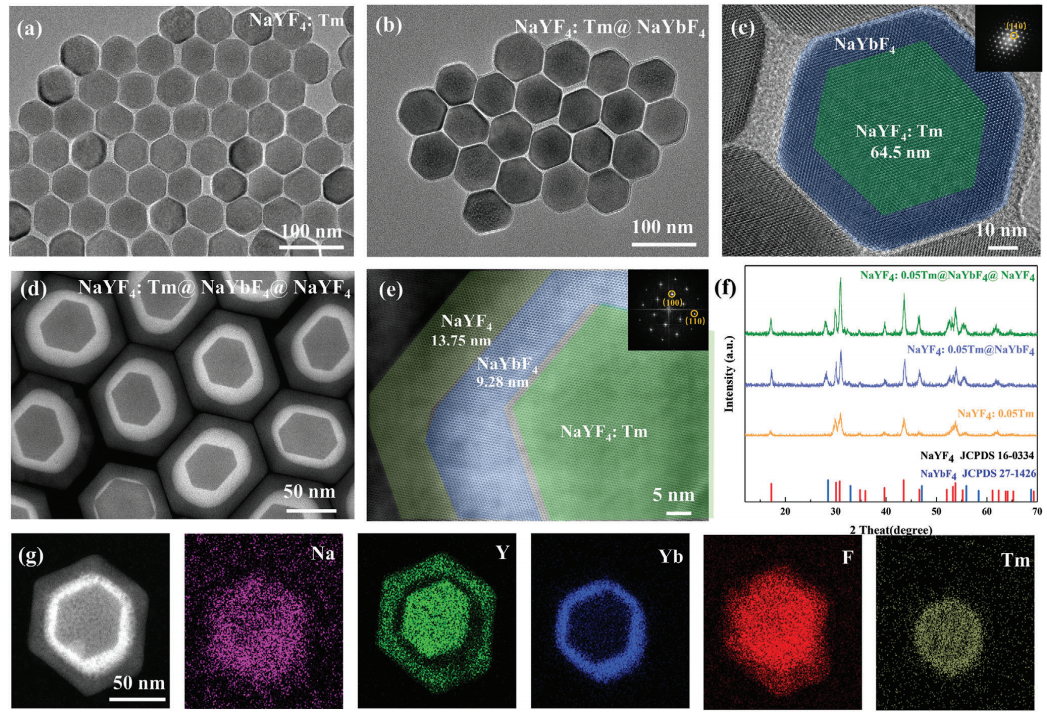
圖2 合成UCNPs的微觀結構表征
所設計的不同核殼結構的UCNP的發光性能和光固化效果如圖3所示。圖3a顯示了具有相同Tm3+濃度的相應UCNP的光致發光(PL)光譜。此外,通過調節Yb3+離子敏化劑和Tm3+離子激活劑(圖3b)的濃度,進一步選擇性地優化了相應UCNP的發光性能。還研究了UCNPs在光引發劑吸收范圍內的PL性能(圖3d)。UCNP的近紅外誘導光聚合性能如圖3e所示。測定了不同曝光時間和近紅外光功率下的光固化比,以評估UCNPs引發劑的效率,如圖3f所示。
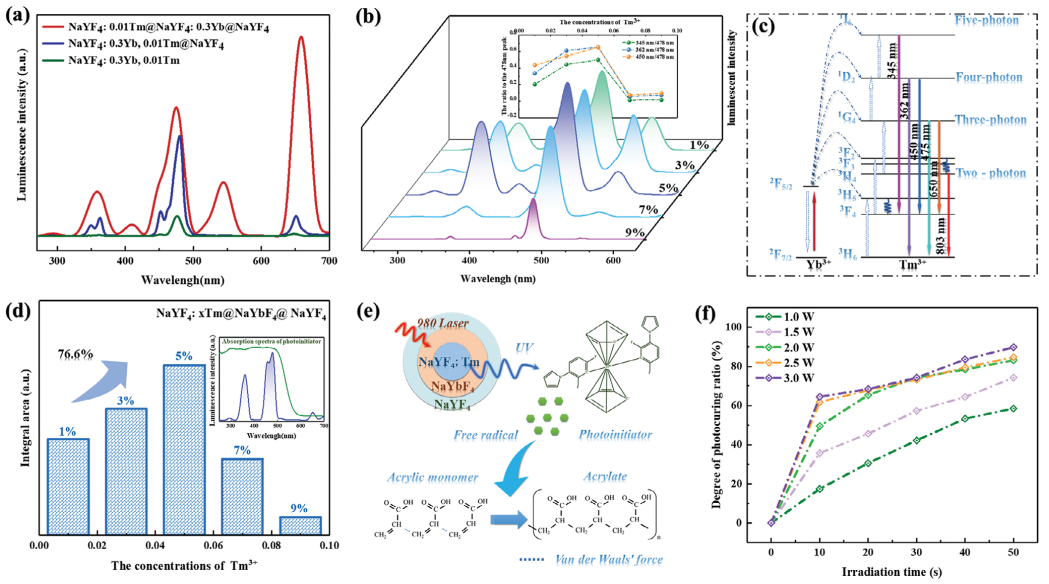
圖3 合成的UCNPs樣品的PL表征及光固化的評價
采用該方法打印斜交骨折(圖4a)、粉碎性骨折(圖4b)、T形骨折和橫向骨折的不同骨折固定支架。圖4a、b中標記為I、II和III的圖像分別顯示了骨折前、骨折后和3D骨骼固定骨,標記為IV的圖像顯示了相應支架的放大視圖。圖4c顯示了一只實驗大鼠的骨折圖像。隨后,將生物墨水溶液注射到實驗大鼠的骨折部位(圖4d)。在計算機控制下,近紅外焦點沿著計劃的路徑移動,以塑造生物墨水溶液(圖4e)。支架在體內無創固定在骨折處(圖4f)。這表明UCNPS輔助的體內非侵入性NIR 3D生物打印技術具有在原位制備復雜組織用于器官重建的潛力,且醫源性損傷最小。
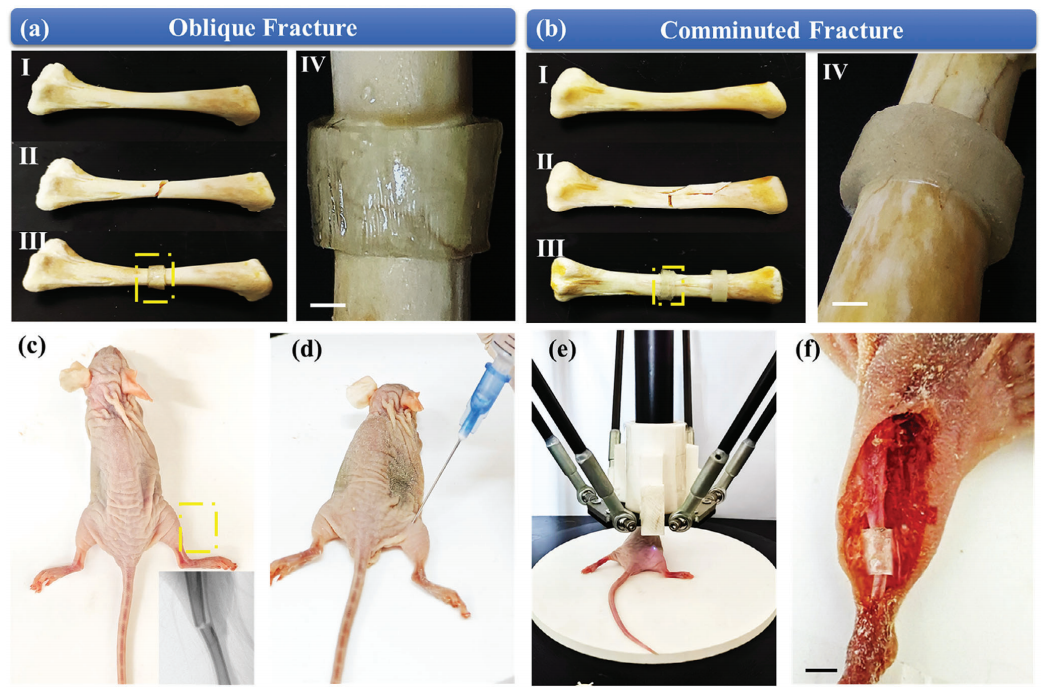
圖4 UCNPS輔助三維生物打印技術在骨折內固定中的應用
總之,基于UCNPs輔助的近紅外聚合過程,研究團隊開發了一種使用配位框架的體內非侵入性3D生物打印成型方法。合理設計了核殼UCNPs,在光引發劑的吸收光譜范圍內提供了高效的藍紫光發射。利用坐標定位框架,為了使近紅外激光沿預定的軌跡進行精確的運動,在給定的三維模型的基礎上制造物體。因此,定制的支架可以從局部骨折部位皮下注射的生物墨水中無創地在體內打印出來進行骨折修復,顯示出在臨床或醫學研究中的潛在應用。
論文:https://doi.org/10.1002/adma.202310617
本文提出了一種基于UCNPS輔助聚合過程的非侵入性3D生物打印骨折固定系統,如圖1所示。采用3D坐標定位框架固定近紅外連續波(CW)激光器,并通過計算機輔助設計3D支架模型來精確控制NIR的移動。將含有UCNPs作為生物鏈接的單體溶液在體內非侵入性地打印成定制的形狀。

圖1 非侵入性固定斷骨的UCNPS輔助的3D生物打印體內示意圖
本研究中,設計了核殼NaYF4: Tm3+@NaYbF4@NaYF4來調制藍紫光發射,以實現高效的光聚合。本研究采用熱注射法逐層合成了一系Tm3+摻雜濃度為5%NaYF4: Tm3+@NaYF4@NaYF4 UCNPs(圖2)。核心材料(NaYF4:Tm3+)的代表性透射電鏡(TEM)圖像顯示單分散的六方顆粒,平均粒徑約為≈65 nm(圖2a)。利用透射電鏡(TEM)和高角度環形暗場掃描透射電鏡(HAADF-STEM)對合成的核-殼UCNPs的形貌進行了進一步評價。TEM圖像顯示,核殼粒子具有均勻分布和單分散性特征,其中中間的NaYF4(圖2b)和非活性的NaYF4(圖2d)的殼層厚度分別為9.28 nm和13.75 nm。此外,如圖2c、e所示的HRTEM圖像中,NaYF4: Tm3+@ NaYF4和NaYF4: Tm3+@ NaYF4@ NaYF4對應的快速傅里葉變換模式進一步表明所制備的UCNPs結晶良好。所得樣品的XRD譜圖及相應結構底部的模擬結果如圖2f所示。能量色散X射線(EDX)圖譜分析進一步證實了Na、Y、Yb、F和Tm的非均相核殼結構和均勻的元素分布(圖2g)。

圖2 合成UCNPs的微觀結構表征
所設計的不同核殼結構的UCNP的發光性能和光固化效果如圖3所示。圖3a顯示了具有相同Tm3+濃度的相應UCNP的光致發光(PL)光譜。此外,通過調節Yb3+離子敏化劑和Tm3+離子激活劑(圖3b)的濃度,進一步選擇性地優化了相應UCNP的發光性能。還研究了UCNPs在光引發劑吸收范圍內的PL性能(圖3d)。UCNP的近紅外誘導光聚合性能如圖3e所示。測定了不同曝光時間和近紅外光功率下的光固化比,以評估UCNPs引發劑的效率,如圖3f所示。

圖3 合成的UCNPs樣品的PL表征及光固化的評價
采用該方法打印斜交骨折(圖4a)、粉碎性骨折(圖4b)、T形骨折和橫向骨折的不同骨折固定支架。圖4a、b中標記為I、II和III的圖像分別顯示了骨折前、骨折后和3D骨骼固定骨,標記為IV的圖像顯示了相應支架的放大視圖。圖4c顯示了一只實驗大鼠的骨折圖像。隨后,將生物墨水溶液注射到實驗大鼠的骨折部位(圖4d)。在計算機控制下,近紅外焦點沿著計劃的路徑移動,以塑造生物墨水溶液(圖4e)。支架在體內無創固定在骨折處(圖4f)。這表明UCNPS輔助的體內非侵入性NIR 3D生物打印技術具有在原位制備復雜組織用于器官重建的潛力,且醫源性損傷最小。

圖4 UCNPS輔助三維生物打印技術在骨折內固定中的應用
總之,基于UCNPs輔助的近紅外聚合過程,研究團隊開發了一種使用配位框架的體內非侵入性3D生物打印成型方法。合理設計了核殼UCNPs,在光引發劑的吸收光譜范圍內提供了高效的藍紫光發射。利用坐標定位框架,為了使近紅外激光沿預定的軌跡進行精確的運動,在給定的三維模型的基礎上制造物體。因此,定制的支架可以從局部骨折部位皮下注射的生物墨水中無創地在體內打印出來進行骨折修復,顯示出在臨床或醫學研究中的潛在應用。
論文:https://doi.org/10.1002/adma.202310617
(責任編輯:admin)
最新內容
熱點內容


 最新報告:全球3D打印醫療
最新報告:全球3D打印醫療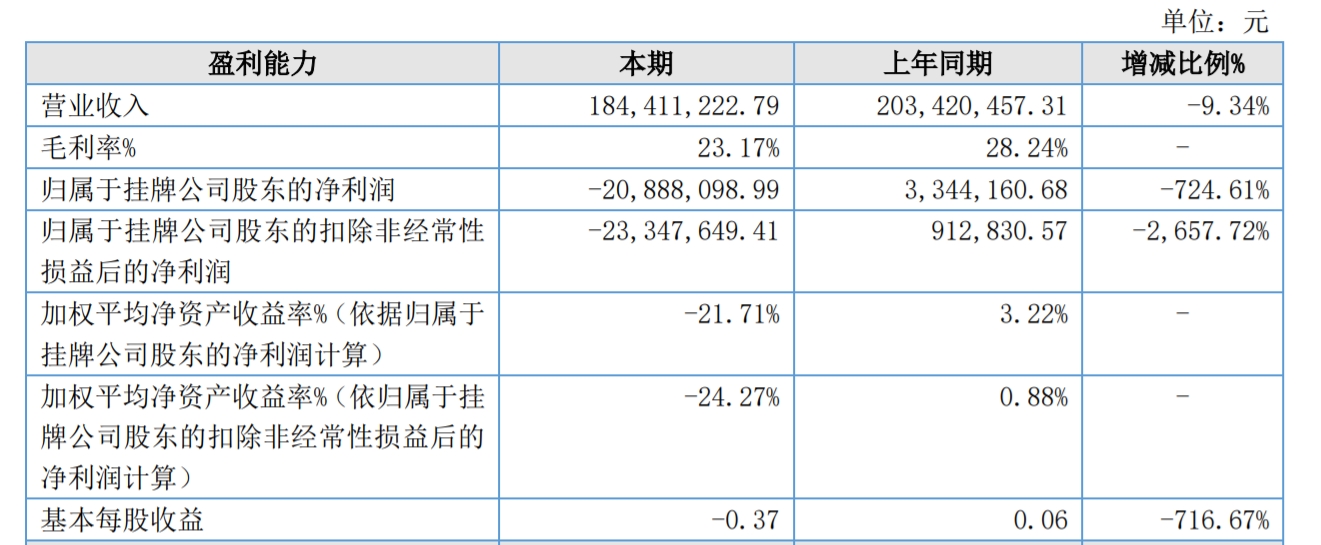 粘結劑噴射3D打印廠商峰華
粘結劑噴射3D打印廠商峰華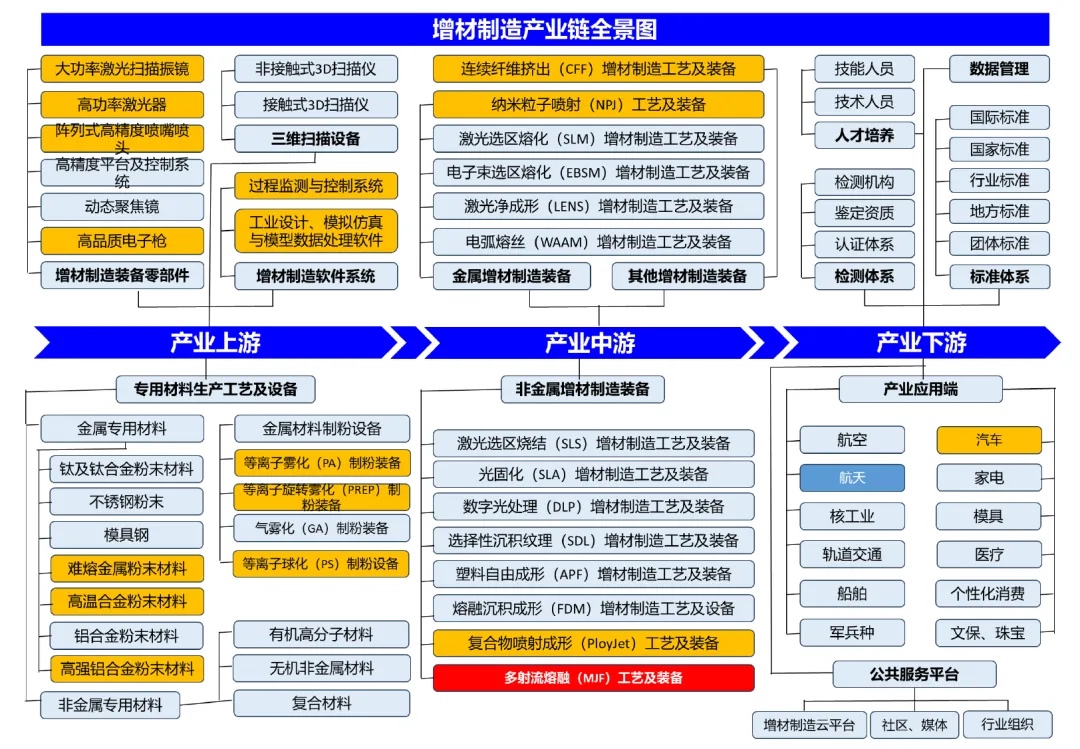 一文看懂醫療3D打印分類(
一文看懂醫療3D打印分類( 江蘇威拉里今年Q1營收破1
江蘇威拉里今年Q1營收破1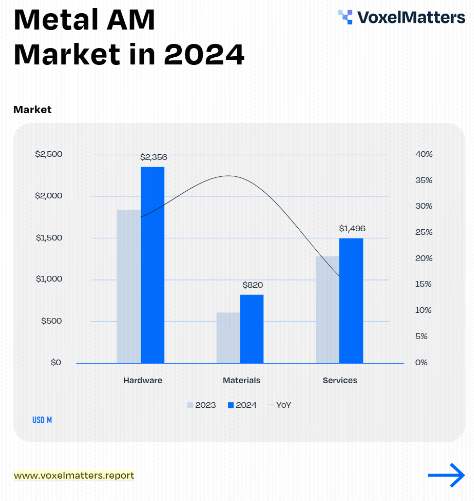 VoxelMatters最新報告:金
VoxelMatters最新報告:金 AM Research報告:3D打印
AM Research報告:3D打印 中南大學在增材制
中南大學在增材制 美國應用科學技術
美國應用科學技術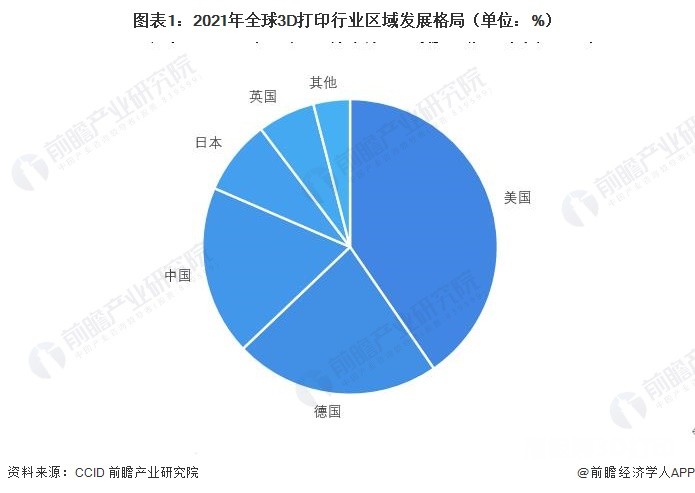 2023年美國3D打印
2023年美國3D打印 淺談3D打印技術的
淺談3D打印技術的 據SmarTech評估,
據SmarTech評估,

