如何利用3D打印技術制備載細胞復合水凝膠體系促進骨軟骨再生
時間:2024-08-13 11:10 來源:EngineeringForLife 作者:admin 閱讀:次
隨著老齡化人口和運動損傷率的上升,骨軟骨 (OC) 缺損正成為一個嚴重的全球健康問題,組織工程植入物為缺損區域提供機械支撐,并作為生物活性因子載體招募原位細胞或重塑局部不利微環境,提示了 OC 再生的潛在替代方法。本期,EFL以發表在雜志《The Innovation》的“3D-bioprinted anisotropic bicellular
living hydrogels boost osteochondral regeneration via reconstruction of
cartilage–bone interface”研究為例,解析如何利用由甲基丙烯酰化明膠(GelMA) 和甲基丙烯酰化海藻酸鹽 (AlgMA)
制成的復合水凝膠作為生物墨水,精確打印同時將關節軟骨祖細胞 (ACPC) 和骨髓間充質干細胞 (BMSC) 嵌入分層中的各向異性雙細胞活水凝膠
(ABLH),促進骨軟骨再生。
為什么選擇ABLH
甲基丙烯酰化明膠(GelMA)具有出色的打印能力和快速的光交聯特點,可提高生物打印的可行性。基于GelMA 出色的生物相容性和 AlgMA 的易操作性,該研究通過雙通道擠出生物3D打印技術制造了由 GelMA 和AlgMA組成的各向異性雙細胞活水凝膠 (ABLH)。可將軟骨來源的ACPC和骨髓來源的 BMSC分配到 ABLH 的分層中,保持了高細胞活力。此外,與均質水凝膠相比,ABLH 中的新軟骨和軟骨下骨同步再生率更高,能夠調節的軟骨-骨-血管串擾,實現更好的軟骨-骨界面。
如何制備ABLH
(1)GelMA和AlgMA的合成及生物墨水制備:將類型A豬皮明膠或海藻酸鈉分別溶解在50°C的PBS中,然后分別加入甲基丙烯酸酐進行反應。之后,將溶液稀釋并在40°C下用蒸餾水透析3天,冷凍干燥3天。在使用前分別進行2小時的紫外線滅菌,隨后將GelMA溶解在37°C的PBS中,加入光引發劑和AlgMA,攪拌均勻,并加入懸浮細胞,制備成生物墨水。(EFL可提供系列GelMA和AlgMA水凝膠產品,詳詢文末區域銷售)
(2)ABLHs的生物打印:使用3D生物打印機進行生物打印,在室溫下以70 kPa的壓力擠出不同比例的生物墨水,逐漸增加擠出壓力直到線條順利擠出或達到最大70 kPa,針頭尺寸為0.3 mm,線條間距設為0.5 mm。(EFL可提供系列擠出式生物3D打印機,點擊鏈接,查看詳情)
ABLH的優勢和作用
(1)ABLH具有較好的物理機械性能和生物相容性
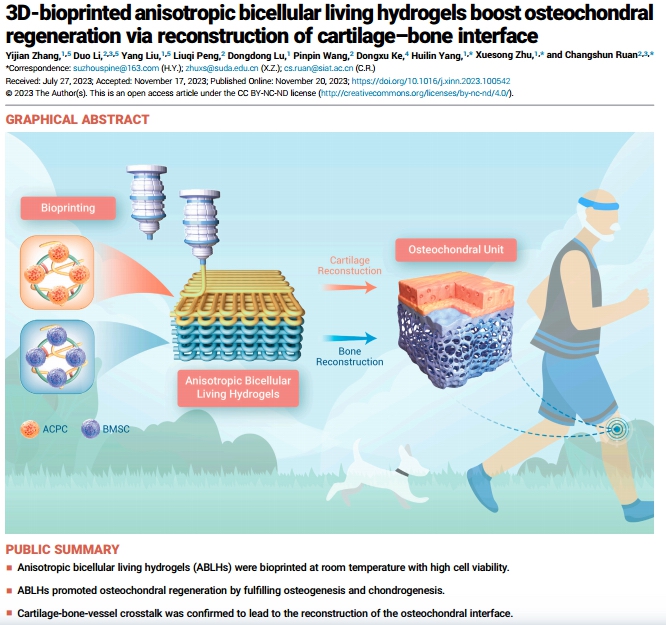
當 GelMA 和 AlgMA 混合時,復合生物墨水保持有效的剪切稀化行為和溫度相關模量,能夠快速交聯。在室溫下以細胞友好的擠出壓力直接打印,并在光交聯后保持構建體的穩定結構。此外,ABLH具有較好的生物相容性,適用于 OC 再生,其中7G3A 是進一步研究的最佳比例。其上方為 ACPC(3 毫米高),下方為 BMSC(5 毫米高)(圖1)。
(2)ABLH 的體外異質譜系分化
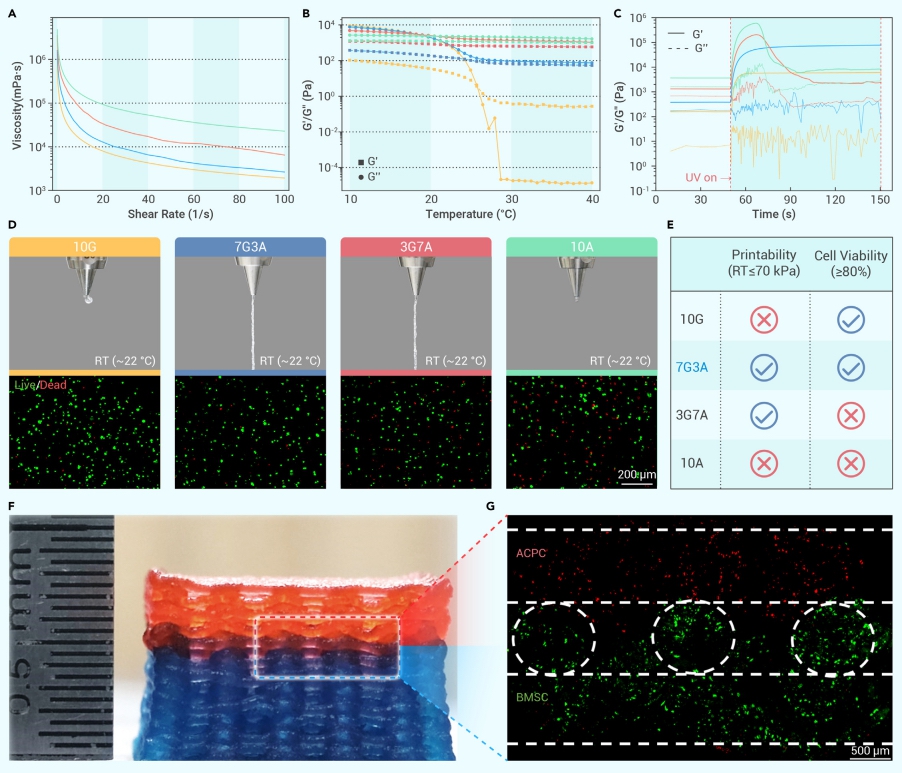
分別從兔軟骨和骨髓中分離的軟骨祖細胞 ACPC 和骨祖細胞 BMSC 在體外單層培養中進行表征和比較。兩種細胞形態相似,然而,BMSC 的克隆形成和增殖能力比 ACPC 強。隨后,使用 3D 生物打印制備了 ACPC 或 BMSC 負載水凝膠,由于在生理溫度下可打印的優勢,生物打印水凝膠促進了內部細胞的存活、增殖和擴散。在體外雙層模型中可見,水凝膠一層為無細胞層,另一層包裹細胞,ACPCs 和 BMSCs 分別在 7 或 14 天內擴散(圖2)。
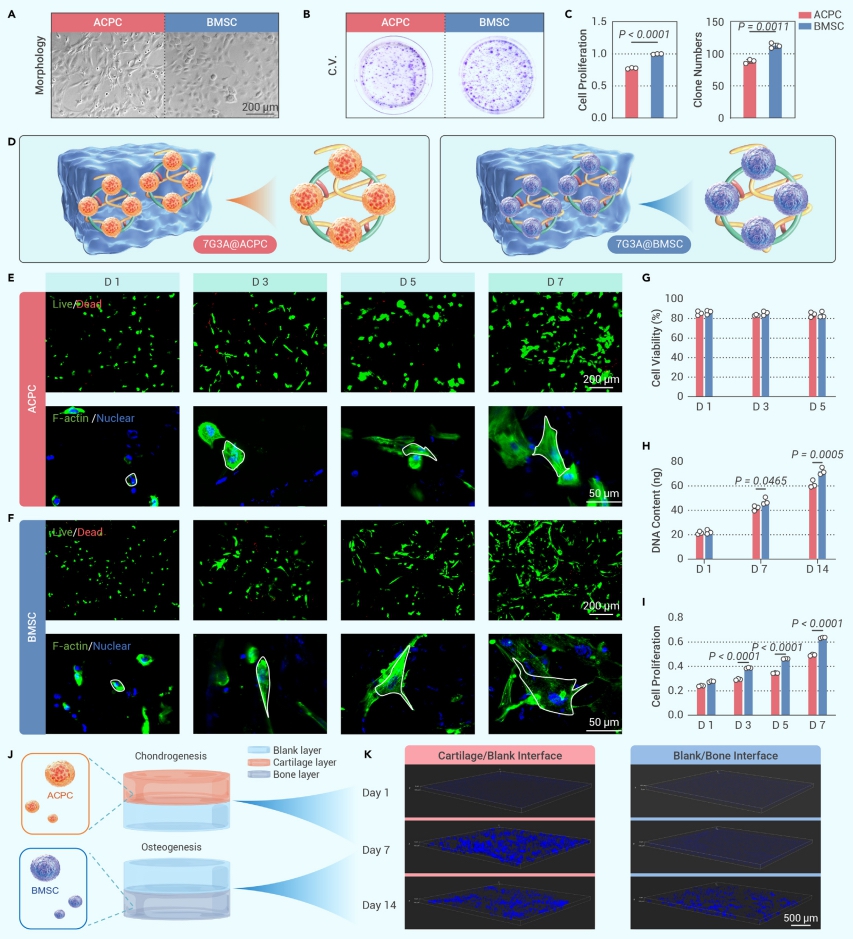
為了進一步評估兩種細胞類型在早期或晚期的定向分化的潛力,將含有 ACPC 或 BMSC 的水凝膠分別暴露于軟骨或成骨培養基中進行 7 或 14 天的誘導。軟骨特異性基因(Col2a1、Acan 和 Sox9)的表達水平在體外分化過程中逐漸增加。番紅 O 染色顯示,在含有 ACPC 的水凝膠中,C-ECM 逐漸改善,免疫組織化學染色顯示COLII和ACAN 的表達在 3D 培養平臺中顯著增加。差異表達基因的熱圖顯示,軟骨形成正調控基因的表達水平增加,但負調控基因的表達水平受到抑制。深入的通路分析表明,激活的線粒體 ATP 合成和氧化磷酸化與 ACPC 向軟骨細胞譜系分化有關。骨特異性標志物的表達水平在 BMSC 負載水凝膠中上調,茜素紅染色可見O-ECM逐漸增強。熱圖顯示成骨正調控基因Gli3、Ddr2 和 Bmp2/4/7 26 的表達水平顯著增加,同時負調控基因Mdk、Hdac7和Grem1的表達被抑制。除此之外,在 BMSC 分化為成骨細胞譜系時還發現了晝夜節律信號傳導。綜上所述,ABLH 在體外 3D 培養中分別促進了 ACPC 或 BMSC 的成軟骨和成骨分化(圖3)。
(3)ABLH 促進體內軟骨修復
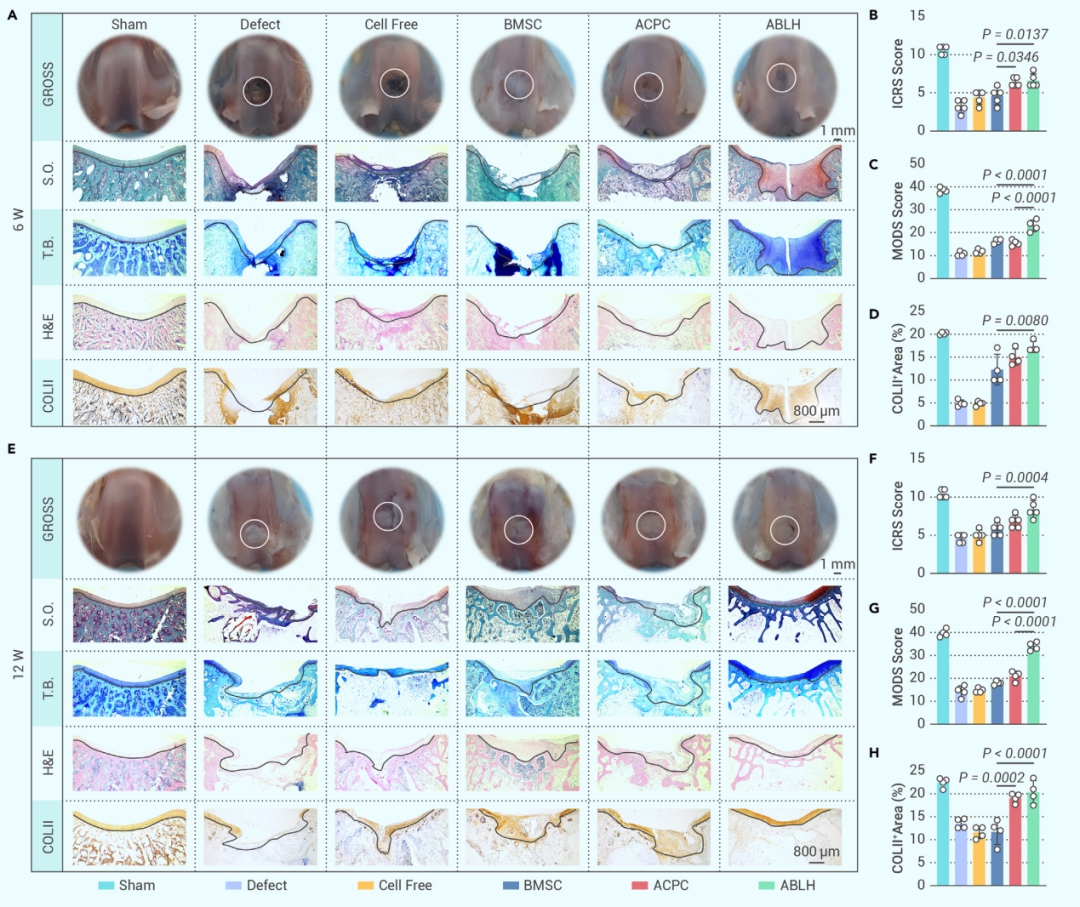
為了探索 ABLH 在軟骨或骨再生方面的潛在治療益處,在兔股骨滑車溝中建立了全層 OC 缺損模型。根據術后 6 周的大體和組織形態學圖像,缺損組中軟骨修復僅發生在主要由纖維結締組織組成的 C-ECM 稀少的表面。無細胞水凝膠表現出脆弱的軟骨連接和空洞骨結構,相比之下,三種載細胞水凝膠表現出相對完整的 OC 單元,形成了軟骨基質豐富的區域,ABLH 有助于位于軟骨和軟骨下骨上部的 C-ECM合成,此外,手術后 12 周,除缺損組的 OC 單元不完整外,四個水凝膠治療組的形態重建均已完成,其中BMSC 水凝膠比 ACPC 水凝膠顯示出更完整的軟骨下骨結構,ABLH 的軟骨再生效率比 ACPC 水凝膠高 23.5%,總的來說,這些發現表明 ABLH 促進軟骨的修復和更新。
(4)ABLH 促進體內骨重塑
通過微型計算機斷層掃描分析和組織學觀察詳細檢查了 ABLH 對骨重建的潛在治療效果。植入后 6 周,與缺損組相比,無細胞水凝膠對骨量改善的作用有限,表明僅靠機械支撐不足以推動新骨形成,ACPC 水凝膠傾向于在表面形成纖維組織狀連接,在深層留下囊腔,不僅誘導下層骨重建,還保持上軟骨層的完整性,提供合適的軟骨和骨發育環境。成熟骨和COLI 的特異性染色顯示,雙細胞水凝膠實現了仿生骨再生,具有高度自然的微觀結構,與含有 BMSC 的水凝膠相比,骨結構成熟度高出 20.8%(圖5)。

(5)ABLH 協調軟骨-骨-血管串擾以進行 OC 單元重建
在體外軟骨生成的過程中,攜帶ACPC的水凝膠中血管生成逐漸減弱,基因集富集分析(GSEA)進一步證實了血管生成的抑制作用。基于基因本體論(GO)的熱圖顯示,早期的軟骨生成過程中有新血管形成,但在軟骨成熟和分化結束后,這些血管的生成明顯減少。在體外成骨過程中,攜帶BMSC的水凝膠中血管生成逐漸增加,GSEA分析證實了在分化過程中血管的逐步形成,GO分析表明,血管生成、重塑和新血管的擴張對于成骨過程中骨基質的重塑必不可少。體內實驗中,通過免疫熒光染色可見,BMSC水凝膠更傾向于促進骨生成,而含有ACPC的水凝膠更有利于軟骨生成。在骨關節炎的進展過程中,軟骨下骨區的H型血管數量增加,甚至侵入軟骨組織,通過抑制H型血管的形成,可以平衡軟骨代謝并減輕骨關節炎的癥狀。在雙細胞水凝膠中,H 型血管被限制在骨層中,而不會穿透和擾亂軟骨穩態,對于獲得更和諧的軟骨-骨界面至關重要。總之,ABLH 重新配置了成骨細胞-軟骨細胞相互作用,以實現分層 OC 單元重建(圖6)。

總結
該研究構建了負載細胞的ABLH,可在室溫下直接打印,保持了細胞生長和分化的能力。在體外3D培養系統中,ACPC可分化為軟骨細胞,BMSC可分化為成骨細胞。原位植入的ABLH在體內OC缺陷模型中實現了上層軟骨細胞外基質(C-ECM)和下層骨細胞外基質(O-ECM)的特異性重建。從機制上看,ABLH通過時空調控軟骨-骨-血管的相互作用,促進了仿生OC單元的重塑。該研究提出了一種利用活細胞的雙層水凝膠生物適應性策略,為高效修復OC缺陷提供了一種全新的方法。
文獻來源:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10746383/

為什么選擇ABLH
甲基丙烯酰化明膠(GelMA)具有出色的打印能力和快速的光交聯特點,可提高生物打印的可行性。基于GelMA 出色的生物相容性和 AlgMA 的易操作性,該研究通過雙通道擠出生物3D打印技術制造了由 GelMA 和AlgMA組成的各向異性雙細胞活水凝膠 (ABLH)。可將軟骨來源的ACPC和骨髓來源的 BMSC分配到 ABLH 的分層中,保持了高細胞活力。此外,與均質水凝膠相比,ABLH 中的新軟骨和軟骨下骨同步再生率更高,能夠調節的軟骨-骨-血管串擾,實現更好的軟骨-骨界面。
如何制備ABLH
(1)GelMA和AlgMA的合成及生物墨水制備:將類型A豬皮明膠或海藻酸鈉分別溶解在50°C的PBS中,然后分別加入甲基丙烯酸酐進行反應。之后,將溶液稀釋并在40°C下用蒸餾水透析3天,冷凍干燥3天。在使用前分別進行2小時的紫外線滅菌,隨后將GelMA溶解在37°C的PBS中,加入光引發劑和AlgMA,攪拌均勻,并加入懸浮細胞,制備成生物墨水。(EFL可提供系列GelMA和AlgMA水凝膠產品,詳詢文末區域銷售)
(2)ABLHs的生物打印:使用3D生物打印機進行生物打印,在室溫下以70 kPa的壓力擠出不同比例的生物墨水,逐漸增加擠出壓力直到線條順利擠出或達到最大70 kPa,針頭尺寸為0.3 mm,線條間距設為0.5 mm。(EFL可提供系列擠出式生物3D打印機,點擊鏈接,查看詳情)
ABLH的優勢和作用
(1)ABLH具有較好的物理機械性能和生物相容性
當 GelMA 和 AlgMA 混合時,復合生物墨水保持有效的剪切稀化行為和溫度相關模量,能夠快速交聯。在室溫下以細胞友好的擠出壓力直接打印,并在光交聯后保持構建體的穩定結構。此外,ABLH具有較好的生物相容性,適用于 OC 再生,其中7G3A 是進一步研究的最佳比例。其上方為 ACPC(3 毫米高),下方為 BMSC(5 毫米高)(圖1)。

圖1 復合生物墨水的制備和可打印性
(2)ABLH 的體外異質譜系分化
分別從兔軟骨和骨髓中分離的軟骨祖細胞 ACPC 和骨祖細胞 BMSC 在體外單層培養中進行表征和比較。兩種細胞形態相似,然而,BMSC 的克隆形成和增殖能力比 ACPC 強。隨后,使用 3D 生物打印制備了 ACPC 或 BMSC 負載水凝膠,由于在生理溫度下可打印的優勢,生物打印水凝膠促進了內部細胞的存活、增殖和擴散。在體外雙層模型中可見,水凝膠一層為無細胞層,另一層包裹細胞,ACPCs 和 BMSCs 分別在 7 或 14 天內擴散(圖2)。

圖2 復合生物打印水凝膠支持嵌入細胞的存活和增殖
為了進一步評估兩種細胞類型在早期或晚期的定向分化的潛力,將含有 ACPC 或 BMSC 的水凝膠分別暴露于軟骨或成骨培養基中進行 7 或 14 天的誘導。軟骨特異性基因(Col2a1、Acan 和 Sox9)的表達水平在體外分化過程中逐漸增加。番紅 O 染色顯示,在含有 ACPC 的水凝膠中,C-ECM 逐漸改善,免疫組織化學染色顯示COLII和ACAN 的表達在 3D 培養平臺中顯著增加。差異表達基因的熱圖顯示,軟骨形成正調控基因的表達水平增加,但負調控基因的表達水平受到抑制。深入的通路分析表明,激活的線粒體 ATP 合成和氧化磷酸化與 ACPC 向軟骨細胞譜系分化有關。骨特異性標志物的表達水平在 BMSC 負載水凝膠中上調,茜素紅染色可見O-ECM逐漸增強。熱圖顯示成骨正調控基因Gli3、Ddr2 和 Bmp2/4/7 26 的表達水平顯著增加,同時負調控基因Mdk、Hdac7和Grem1的表達被抑制。除此之外,在 BMSC 分化為成骨細胞譜系時還發現了晝夜節律信號傳導。綜上所述,ABLH 在體外 3D 培養中分別促進了 ACPC 或 BMSC 的成軟骨和成骨分化(圖3)。

圖3 負載ACPC 或 BMSC 的生物打印結構對軟骨形成或成骨的影響
(3)ABLH 促進體內軟骨修復
為了探索 ABLH 在軟骨或骨再生方面的潛在治療益處,在兔股骨滑車溝中建立了全層 OC 缺損模型。根據術后 6 周的大體和組織形態學圖像,缺損組中軟骨修復僅發生在主要由纖維結締組織組成的 C-ECM 稀少的表面。無細胞水凝膠表現出脆弱的軟骨連接和空洞骨結構,相比之下,三種載細胞水凝膠表現出相對完整的 OC 單元,形成了軟骨基質豐富的區域,ABLH 有助于位于軟骨和軟骨下骨上部的 C-ECM合成,此外,手術后 12 周,除缺損組的 OC 單元不完整外,四個水凝膠治療組的形態重建均已完成,其中BMSC 水凝膠比 ACPC 水凝膠顯示出更完整的軟骨下骨結構,ABLH 的軟骨再生效率比 ACPC 水凝膠高 23.5%,總的來說,這些發現表明 ABLH 促進軟骨的修復和更新。

圖4 ABLH 促進體內軟骨再生
(4)ABLH 促進體內骨重塑
通過微型計算機斷層掃描分析和組織學觀察詳細檢查了 ABLH 對骨重建的潛在治療效果。植入后 6 周,與缺損組相比,無細胞水凝膠對骨量改善的作用有限,表明僅靠機械支撐不足以推動新骨形成,ACPC 水凝膠傾向于在表面形成纖維組織狀連接,在深層留下囊腔,不僅誘導下層骨重建,還保持上軟骨層的完整性,提供合適的軟骨和骨發育環境。成熟骨和COLI 的特異性染色顯示,雙細胞水凝膠實現了仿生骨再生,具有高度自然的微觀結構,與含有 BMSC 的水凝膠相比,骨結構成熟度高出 20.8%(圖5)。

圖5 ABLH 加速了體內軟骨下骨的形成和重塑
(5)ABLH 協調軟骨-骨-血管串擾以進行 OC 單元重建
在體外軟骨生成的過程中,攜帶ACPC的水凝膠中血管生成逐漸減弱,基因集富集分析(GSEA)進一步證實了血管生成的抑制作用。基于基因本體論(GO)的熱圖顯示,早期的軟骨生成過程中有新血管形成,但在軟骨成熟和分化結束后,這些血管的生成明顯減少。在體外成骨過程中,攜帶BMSC的水凝膠中血管生成逐漸增加,GSEA分析證實了在分化過程中血管的逐步形成,GO分析表明,血管生成、重塑和新血管的擴張對于成骨過程中骨基質的重塑必不可少。體內實驗中,通過免疫熒光染色可見,BMSC水凝膠更傾向于促進骨生成,而含有ACPC的水凝膠更有利于軟骨生成。在骨關節炎的進展過程中,軟骨下骨區的H型血管數量增加,甚至侵入軟骨組織,通過抑制H型血管的形成,可以平衡軟骨代謝并減輕骨關節炎的癥狀。在雙細胞水凝膠中,H 型血管被限制在骨層中,而不會穿透和擾亂軟骨穩態,對于獲得更和諧的軟骨-骨界面至關重要。總之,ABLH 重新配置了成骨細胞-軟骨細胞相互作用,以實現分層 OC 單元重建(圖6)。

圖6 ABLH 協調軟骨-骨-血管串擾以重建 OC 單元
總結
該研究構建了負載細胞的ABLH,可在室溫下直接打印,保持了細胞生長和分化的能力。在體外3D培養系統中,ACPC可分化為軟骨細胞,BMSC可分化為成骨細胞。原位植入的ABLH在體內OC缺陷模型中實現了上層軟骨細胞外基質(C-ECM)和下層骨細胞外基質(O-ECM)的特異性重建。從機制上看,ABLH通過時空調控軟骨-骨-血管的相互作用,促進了仿生OC單元的重塑。該研究提出了一種利用活細胞的雙層水凝膠生物適應性策略,為高效修復OC缺陷提供了一種全新的方法。
文獻來源:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10746383/
(責任編輯:admin)
最新內容
熱點內容


 Fabric8Labs推出AI芯片定
Fabric8Labs推出AI芯片定 Titomic又一合作,將與nuF
Titomic又一合作,將與nuF 荷蘭公司將開設3D打印船舶
荷蘭公司將開設3D打印船舶 Chicago Additive推出AMOS
Chicago Additive推出AMOS 590MHz帶寬+超90%輻射效率
590MHz帶寬+超90%輻射效率 威斯康星大學麥迪遜分校工
威斯康星大學麥迪遜分校工 突破性生物3D打印
突破性生物3D打印 迪拜LEAP 71公司
迪拜LEAP 71公司 3D生物打印構建內
3D生物打印構建內 《Small Science
《Small Science 南洋理工-劍橋大
南洋理工-劍橋大 清華大學:抗拉強
清華大學:抗拉強

