個性化增材制造醫療器械注冊技術審查指導原則(2)
表1相關產品標準
|
標準編號 |
標準名稱 |
|
YY/T 0316-2016 |
《醫療器械 風險管理對醫療器械的應用》 |
|
ISO 17296-2:2015 |
Additive manufacturing -- General principles -- Part 2: Overview of process categories and feedstock |
|
ISO 17296-3:2014 |
Additive manufacturing -- General principles -- Part 3: Main characteristics and corresponding test methods |
|
ISO 17296-4:2014 |
Additive manufacturing -- General principles -- Part 4: Overview of data processing |
|
ASTM F2924-12 |
Standard Specification for Additive Manufacturing Titanium-6 Aluminum-4 Vanadium with Powder Bed Fusion |
|
ASTM F3001-14 |
Standard Specification for Additive Manufacturing Titanium-6 Aluminum-4 Vanadium ELI(Extra Low Interstitial)with Powder Bed Fusion |
|
ASTM F3091/F3091M-14 |
Standard Specification for Powder Bed Fusion of Plastic Materials |
|
ASTM F3049-14 |
Standard Guide for Characterizing Properties of Metal Powders Used for Additive Manufacturing Processes |
|
ISO/ASTM 52921:2013 |
Standard terminology for additive manufacturing -- Coordinate systems and test methodologies |
|
ISO/ASTM 52915:2016 |
Specification for additive manufacturing file format(AMF)Version 1.2 |
|
ISO/ASTM 52901:2017 |
Additive manufacturing -- General principles -- Requirements for purchased AM parts |
|
ISO/ASTM 52900:2015 |
Additive manufacturing -- General principles – Terminology |
(七)產品適用范圍/預期用途
描述產品具體的使用部位、適用人群、使用情形、適應癥和禁忌癥、預期使用環境。明確操作該產品應當具備的技能/知識/培訓。說明預期與申報產品配合使用的醫療器械的型號規格。
(八)產品風險分析資料
根據YY/T 0316-2016《醫療器械 風險管理對醫療器械的應用》,充分識別產品的個性化設計、原材料采購、生產加工過程、產品包裝、滅菌、運輸、貯存、使用等產品生命周期內各個環節的安全特征,從生物學危險(源)、環境危險(源)、有關使用的危險(源)、功能失效、能量危險(源)(若涉及)、老化及存儲不當引起的危險(源)等方面,對產品進行全面的風險分析,并詳述所采取的風險控制措施。
提供產品上市前對其風險管理活動進行全面評審所形成的風險管理報告,此報告旨在說明并承諾風險管理計劃已被恰當地實施,并經過驗證后判定綜合剩余風險是可接受的,已有恰當的方法獲得產品設計、制造、出廠后流通和臨床應用的相關信息。
風險管理報告應當包括風險分析、風險評價、風險控制等產品風險管理的相關資料,至少應當包括產品安全特征清單、產品可預見的危害及危害分析清單(說明危害、可預見事件序列即危害成因分析)、危害處境和可能發生的損害之間的關系、風險評價、風險控制措施以及剩余風險評價匯總表。
(九)產品的研究要求
至少應當包含如下內容:
1.材料表征
結合材料屬性和工藝流程,分別表征打印前、打印后和終產品材料的化學成分和組成、微觀結構、力學性能等,明確各項性能指標的符合標準。
2.產品結構和機械性能
表征產品的結構。例如采用體視學方法、Micro-CT等表征3D打印多孔結構,明確關鍵特征參數,如孔單元形態、孔徑大小及其分布、絲徑、孔隙率、平均孔隙截距、孔隙漸變梯度、內部連通性、多孔結構的厚度等。
根據醫療器械的材料屬性和預期用途,應當進行產品動靜態力學性能測試,如剛度、屈服強度、極限強度、蠕變/粘彈性、疲勞和磨損等。個性化增材制造產品可以采用與傳統制造工藝產品相同的測試方法,可根據產品適用的相關指導原則、標準要求確定需要的功能試驗項目、試驗方法。
應當使用等效模型進行機械試驗。等效模型應當與申報產品經過所有相同的打印、打印后處理、清洗、滅菌等工藝步驟,且滿足臨床預期的結構和尺寸要求。提供等效模型確定的合理性論證,如使用3D計算機模擬(如有限元分析)等方法。
3.生物相容性
申報產品的生物相容性評價應當按照GB/T 16886.1—2011《醫療器械生物學評價 第1部分:風險管理過程中的評價與試驗》中的系統方法框圖及《國家食品藥品監督管理局關于印發醫療器械生物學評價和審查指南的通知》(國食藥監械〔2007〕345號)中的審查要點進行風險評價,在缺乏相關數據時,應當進行必要的生物相容性試驗。
4.清洗和滅菌
清洗工藝驗證和滅菌工藝驗證應當根據產品特點選擇最差情況,如清洗工藝驗證中考慮材料殘留,滅菌工藝驗證中考慮表面積、孔隙率、孔徑等影響微生物負載的因素。論證清洗驗證方法的有效性,必要時應當采用破壞性試驗對其清洗方法進行驗證。考慮到增材制造工藝的復雜性,其多孔結構的清洗工藝驗證應當由注冊申請人完成。
對于經輻照滅菌的產品,需明確輻照劑量及相關的驗證報告,具體的劑量確定依據可參照GB 18280系列標準。對于經環氧乙烷滅菌的產品,需提供滅菌結果確認和過程控制報告,具體可參照GB 18279系列標準。對于經濕熱滅菌的產品,需提供滅菌工藝參數及驗證報告,具體可參考GB 18278系列標準。
對于非滅菌包裝的終產品,應當明確推薦采用的滅菌方法并提供確定依據,建議參考WS310.2-2016《醫院消毒供應中心 第2部分:清洗消毒及滅菌技術操作規范》。采用其他滅菌方法的應當提供方法合理性論證和工藝確認及過程控制報告。
5.產品有效期和包裝
申報產品應當參照現行有效的《無源植入性醫療器械貨架有效期注冊申報資料指導原則(2017年修訂版)》(國家食品藥品監督管理總局通告2017年第75號)提供產品貨架有效期的驗證資料。貨架有效期驗證資料中需要明確滅菌產品的包裝材料、包裝工藝及方法、加速老化試驗或/和實時老化試驗報告。加速老化試驗中應明確試驗溫度、濕度、加速老化時間的確定依據。老化試驗后需要對包裝完整性和包裝強度的評價試驗,如染色液穿透試驗、氣泡試驗、材料密封強度試驗、模擬運輸等。若申請人提供其他醫療器械產品的貨架有效期驗證資料,則應當提供其與本次申報產品在原材料、滅菌方法、滅菌劑量、包裝材料、包裝工藝、包裝方式及其它影響阻菌性能的因素方面具有等同性的證明資料。不同包裝、不同滅菌方式的產品應當分別提供驗證資料。
對于非滅菌產品,貨架有效期的確定應當建立在科學試驗的基礎上,如穩定性試驗,其目的是考察產品在溫度、濕度、光線的影響下隨時間變化的規律,為產品的生產、包裝、貯存、運輸條件提供科學依據,同時通過試驗建立產品的有效期。因此,申請人在申報產品注冊時應當提供產品有效期的驗證報告及內包裝材料信息。
(責任編輯:admin)


 MGA醫療聯盟:以系統化思
MGA醫療聯盟:以系統化思 國家統計局:中國3D打印設
國家統計局:中國3D打印設 ICC將制定混凝土3D打印墻
ICC將制定混凝土3D打印墻 三項增材制造金屬粉末國家
三項增材制造金屬粉末國家 工信部等新規:工業級3D打
工信部等新規:工業級3D打 2027年產值突破1500億元(
2027年產值突破1500億元( 洞察2023:全球藥
洞察2023:全球藥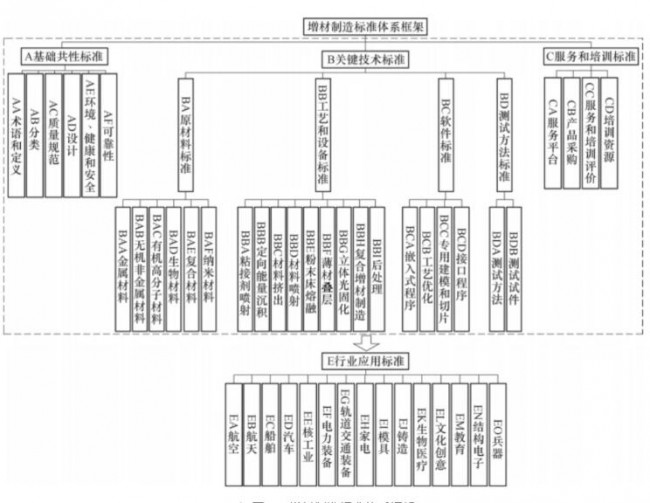 3D打印-增材制造
3D打印-增材制造 《智能制造知識體
《智能制造知識體 2021年中國及31省
2021年中國及31省 全球工程標準協會
全球工程標準協會 毛孔的SLM金屬3D
毛孔的SLM金屬3D

