個性化增材制造醫(yī)療器械注冊技術(shù)審查指導(dǎo)原則(4)
1.3后處理方法以及驗證
后處理可能包括機加工、熱等靜壓、熱處理、支撐物或殘留粉末去除、表面處理等。應(yīng)當(dāng)評估后處理工藝對材料和終產(chǎn)品的安全、有效性的影響。
1.4產(chǎn)品的測試
個性化增材制造醫(yī)療器械半成品和成品應(yīng)當(dāng)考慮下列測試:
1.4.1產(chǎn)品材料的化學(xué)成分和力學(xué)性能應(yīng)當(dāng)符合申報材料的相關(guān)標(biāo)準(zhǔn),例如內(nèi)部質(zhì)量、顯微組織、力學(xué)強度、規(guī)定非比例延伸率等。
1.4.2產(chǎn)品表面質(zhì)量、尺寸及精度。評價產(chǎn)品與提供的3D打印的骨骼模型的匹配性及適用性。
1.4.3產(chǎn)品內(nèi)部結(jié)構(gòu),例如仿生多孔結(jié)構(gòu)的孔徑、絲徑、孔隙率等。
1.4.4產(chǎn)品的功能性評價,例如產(chǎn)品的靜態(tài)軸向壓縮剛度、靜態(tài)軸向壓縮最大載荷、靜態(tài)軸向剪切最大載荷、動態(tài)軸向壓縮強度、動態(tài)軸向剪切強度、靜態(tài)扭轉(zhuǎn)最大扭矩、動態(tài)扭轉(zhuǎn)性能評價、靜態(tài)軸向壓縮沉陷剛度、動態(tài)疲勞等,這些分析應(yīng)當(dāng)與產(chǎn)品預(yù)期使用部位和預(yù)期用途相適宜。
最差情況的選擇應(yīng)當(dāng)結(jié)合產(chǎn)品材料屬性測試和有限元模擬等生物力學(xué)分析。如必要時,可通過對抗壓能力、抗拉能力、抗扭轉(zhuǎn)能力、抗側(cè)彎能力的測試,獲得有限元分析所需的材料屬性參數(shù)。
1.4.5產(chǎn)品的生物相容性測試。
1.4.6產(chǎn)品的清洗及無菌檢測。
2.增材制造醫(yī)療器械醫(yī)工交互能力確認(rèn)
2.1個性化設(shè)計
本部分內(nèi)容是在《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》(國家食品藥品監(jiān)督管理總局公告2014年第64號)設(shè)計與開發(fā)章節(jié)的基礎(chǔ)上,結(jié)合個性化增材制造醫(yī)療器械的特殊性制定,預(yù)期滿足用于注冊申報的個性化增材制造醫(yī)療器械設(shè)計開發(fā)的基本要求。
應(yīng)當(dāng)由臨床醫(yī)生、影像科醫(yī)生、工程師等多學(xué)科背景人員共同組建醫(yī)工交互團隊。參與醫(yī)工交互設(shè)計的人員,應(yīng)當(dāng)經(jīng)過與其崗位要求相適應(yīng)的培訓(xùn),具有相應(yīng)理論知識和實際操作能力,并制定人員上崗前醫(yī)工交互能力確認(rèn)的標(biāo)準(zhǔn)操作流程,明確相關(guān)人員在設(shè)計開發(fā)中的職責(zé)與權(quán)限。設(shè)計與開發(fā)環(huán)節(jié)的相關(guān)過程應(yīng)當(dāng)文件化。
2.1.1設(shè)計開發(fā)的輸入
醫(yī)工交互設(shè)計人員共同完成產(chǎn)品設(shè)計,簽字確認(rèn)個性化增材制造產(chǎn)品設(shè)計所需的設(shè)計要求清單,包括患者影像數(shù)據(jù)、手術(shù)方案、個性化增材制造產(chǎn)品要求(材料、結(jié)構(gòu)、尺寸、包裝及交付方式等)、配套使用的器械要求等滿足產(chǎn)品預(yù)期用途的相關(guān)參數(shù)和要求。
患者影像數(shù)據(jù)應(yīng)當(dāng)包括滿足臨床需求的關(guān)鍵參數(shù),記錄所使用軟件名稱和版本號,采取明確措施減少CT和MRI檢查中含金屬假體的偽影,并明確可追溯性。采集患者影像數(shù)據(jù)時,要確保信息安全、完整,并采取可靠措施保護患者隱私。上述內(nèi)容由影像科醫(yī)生簽字確認(rèn)。
2.1.2設(shè)計開發(fā)驗證和確認(rèn)
針對個性化增材制造醫(yī)療器械的數(shù)字化模型和制造加工品進行設(shè)計開發(fā)的驗證和確認(rèn)。可以采用一種或多種方法驗證產(chǎn)品對解剖匹配性、生物力學(xué)性能等設(shè)計開發(fā)輸入和預(yù)期用途的滿足性。方法可以包括計算機模擬分析、實驗室檢測、臨床評估等。
當(dāng)患者的數(shù)據(jù)在原驗證模型參數(shù)范圍之內(nèi),可以采取有限元分析等評價方法評估其風(fēng)險。如果患者的解剖和病變范圍超過原設(shè)計要求,應(yīng)當(dāng)重新進行評估和驗證。對于超出已批準(zhǔn)注冊范圍的特征結(jié)構(gòu)及參數(shù)應(yīng)當(dāng)另行注冊申報。
設(shè)計驗證和確認(rèn)內(nèi)容應(yīng)當(dāng)形成《個性化增材制造產(chǎn)品設(shè)計方案》,至少包含設(shè)計流程圖、材料要求、結(jié)構(gòu)特征、包裝方式、交付方式和時間、產(chǎn)品技術(shù)要求等內(nèi)容及記錄。醫(yī)工交互團隊共同確認(rèn)并簽字。
2.1.3設(shè)計開發(fā)的更改
在個性化增材制造產(chǎn)品的設(shè)計或生產(chǎn)過程中,應(yīng)當(dāng)充分考慮患者病情變化等因素導(dǎo)致設(shè)計不滿足輸入的情況。如果進行設(shè)計更改,應(yīng)當(dāng)提供充分的理由,再次由醫(yī)工交互團隊簽字確認(rèn)。
2.2產(chǎn)品的交付
當(dāng)個性化醫(yī)療器械產(chǎn)品制造完成后,在交付給臨床醫(yī)生時應(yīng)當(dāng)簽字確認(rèn)并存檔。存檔內(nèi)容包括個性化醫(yī)療器械的數(shù)字化模型、產(chǎn)品編號、患者標(biāo)識等。
2.3產(chǎn)品的使用
從事個性化增材制造醫(yī)療器械產(chǎn)品的申請人與醫(yī)療機構(gòu)應(yīng)當(dāng)制定相應(yīng)的制度,并共同遵守:
2.3.1使用個性化醫(yī)療器械開展手術(shù)的醫(yī)療機構(gòu)應(yīng)當(dāng)具有相應(yīng)資質(zhì),必須在衛(wèi)生主管部門認(rèn)定的具有專業(yè)技術(shù)資格的醫(yī)療機構(gòu)使用。臨床醫(yī)生至少應(yīng)當(dāng)具有從業(yè)經(jīng)驗,并經(jīng)過必要的培訓(xùn)。
2.3.2個性化醫(yī)療器械僅用于需要使用個性化醫(yī)療器械的患者,患者或者其監(jiān)護人應(yīng)當(dāng)簽署知情同意書。申請人及醫(yī)療機構(gòu)有權(quán)獲得患者相應(yīng)的數(shù)據(jù)信息,同時須保證相關(guān)信息安全。
2.3.3個性化醫(yī)療器械是基于患者的影像數(shù)據(jù)進行研制,臨床醫(yī)生應(yīng)當(dāng)保證患者全部原始數(shù)據(jù)的真實性、準(zhǔn)確性和可用性。
2.3.4臨床醫(yī)生應(yīng)當(dāng)參與整體方案的設(shè)計,并對最終產(chǎn)品、配套手術(shù)工具及相關(guān)手術(shù)方案進行確認(rèn)。
2.3.5未使用的個性化醫(yī)療器械由申請人負(fù)責(zé)收回,不得再用于臨床。
2.3.6申請人和醫(yī)療機構(gòu)應(yīng)當(dāng)按照《醫(yī)療器械不良事件監(jiān)測和再評價管理辦法》有關(guān)規(guī)定開展個性化醫(yī)療器械不良事件監(jiān)測工作。
在產(chǎn)品全生命周期中,申請人還應(yīng)當(dāng)完成以下內(nèi)容:
2.3.7申請人應(yīng)當(dāng)建立數(shù)據(jù)庫,用于保存病患的數(shù)據(jù)信息,并由專人負(fù)責(zé)維護保管。除非得到患者及醫(yī)療機構(gòu)的許可,申請人不得將數(shù)據(jù)提供給其他機構(gòu)或個人。
2.3.8申請人應(yīng)當(dāng)建立控制程序,定期收集、評估個性化醫(yī)療器械臨床使用效果,用于改進產(chǎn)品性能和降低產(chǎn)品風(fēng)險。應(yīng)當(dāng)建立個性化醫(yī)療器械的使用報告制度、信息追溯制度、再評價制度和終止產(chǎn)品應(yīng)用制度。
2.3.9評價嚴(yán)重不良事件可以采用按照個性化醫(yī)療器械生產(chǎn)工藝文件,在同等生產(chǎn)加工條件下生產(chǎn)的個性化醫(yī)療器械樣品。申請人應(yīng)當(dāng)保存每個個性化醫(yī)療器械的設(shè)計生產(chǎn)資料,確保每個個性化增材制造產(chǎn)品的重現(xiàn)性。
(責(zé)任編輯:admin)
下一篇:全球工程標(biāo)準(zhǔn)協(xié)會已發(fā)布了首個用于航空航天領(lǐng)域的增材制造規(guī)范


 MGA醫(yī)療聯(lián)盟:以系統(tǒng)化思
MGA醫(yī)療聯(lián)盟:以系統(tǒng)化思 國家統(tǒng)計局:中國3D打印設(shè)
國家統(tǒng)計局:中國3D打印設(shè) ICC將制定混凝土3D打印墻
ICC將制定混凝土3D打印墻 三項增材制造金屬粉末國家
三項增材制造金屬粉末國家 工信部等新規(guī):工業(yè)級3D打
工信部等新規(guī):工業(yè)級3D打 2027年產(chǎn)值突破1500億元(
2027年產(chǎn)值突破1500億元( 洞察2023:全球藥
洞察2023:全球藥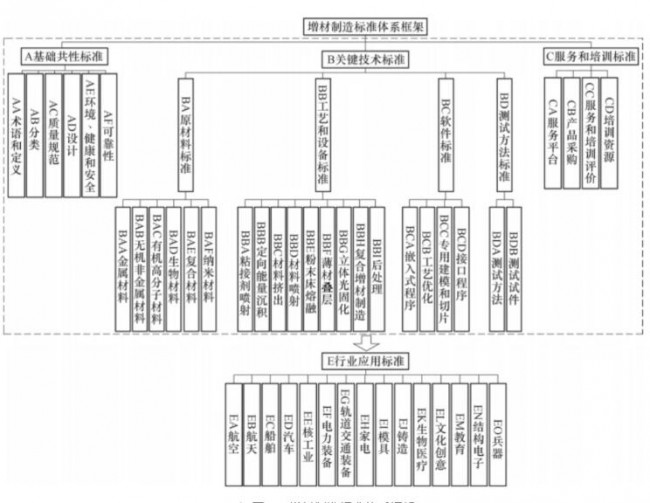 3D打印-增材制造
3D打印-增材制造 《智能制造知識體
《智能制造知識體 2021年中國及31省
2021年中國及31省 全球工程標(biāo)準(zhǔn)協(xié)會
全球工程標(biāo)準(zhǔn)協(xié)會 毛孔的SLM金屬3D
毛孔的SLM金屬3D

