個性化增材制造醫療器械注冊技術審查指導原則(5)
(十三)產品的臨床評價要求
個性化增材制造醫療器械臨床評價的目標是為了獲得安全性和有效性數據,評價個性化增材制造醫療器械在治療特殊病例和特殊解剖部位疾患的作用。如通過臨床試驗評價產品安全性和有效性,臨床試驗應當符合《醫療器械臨床試驗質量管理規范》(國家食品藥品監督管理總局中華人民共和國國家衛生和計劃生育委員會令第25號)的相應要求,臨床試驗機構應當按要求在國家藥品監督管理局備案。
1. 無可替代產品情形
病源有限或標準化產品不適宜作為對照的,可以開展不少于10例的觀察研究,每個臨床機構應當開展不少于5例研究。可以和申請人以往的歷史數據進行綜合分析,符合本指導原則要求的可以納入統計。屬于臨床急需或罕見病情況的可以依據相關規定進行試驗。
應當注意對個性化增材制造產品特定安全性和有效性指標進行觀察。例如個性化醫療器械使用過程中發生的不良事件、使用過程中臨床醫生操作性能、植入假體的初始穩定性、患者的功能恢復及生存質量的早期改善等。
根據疾病類型和臨床獲益確定研究終點,研究終點為至少3個月,但該臨床病例應當給予持續跟蹤,直至臨床轉歸的穩定狀態。
2. 需要進行同類對照產品情形
如可設立陽性對照,則應當參照隨機、平行、對照的前瞻性臨床試驗原則,進行非劣效性臨床試驗。
2.1入選、排除標準
對于需要進行臨床試驗的個性化增材制造醫療器械,其受試者應當嚴格遵從患者獲益的前提,從需要進行個性化醫療器械治療的患者人群中選出。申請人及臨床試驗機構應當根據申報產品的設計特征及其適用范圍制定其臨床試驗的入選/排除/退出標準,不符合所有入選標準或者符合任何一項排除標準的研究對象應被排除。
2.2受試者退出標準及退出受試者的處理
2.2.1退出標準
①受試者撤回知情同意書;
②嚴重違反驗證方案;
③研究者認為不再適合繼續進行臨床驗證者;
④在臨床驗證期間妊娠的婦女;
⑤受試者死亡;
⑥受試者失訪;
⑦申辦者要求終止驗證。
2.2.2退出受試者的處理
①最后一次生命體征記錄、術后情況和局部體征檢查資料、影像學檢查資料,記錄合并用藥和不良事件等;
②將終止驗證的時間和原因詳細記錄在病例報告表上;
③對因不良事件而終止驗證的病人必須隨訪至不良事件得到解決或穩定。
④《醫療器械臨床試驗質量管理規范》規定的其他相關要求。
2.3個性化醫療器械植入手術操作執行要求
為降低手術植入環節的風險,應當針對不同部位的個性化醫療器械應用,建立手術操作的文本及圖示規范指導實施。根據需要選擇計算機導航和輔助導板進行精確手術,以確保個性化醫療器械的精準安裝。
2.4臨床試驗持續時間與窗口期
臨床試驗的持續時間取決于安全性和有效性數據的獲取,針對個性化3D打印器械的孔隙結構利于骨長入形成遠期穩定的特點,臨床試驗可重點考量器械的初始穩定性,臨床試驗持續時間至少3個月。隨訪內容包括患者主訴、體格檢查、影像評價、功能評估等。
2.5臨床試驗評價指標及判定標準
對于需進行臨床試驗的個性化醫療器械,根據植入部位不同,參考現有常規產品或根據病變部位特點設立主要評價指標和次要評價指標,并明確評估方法。主要評價指標是與試驗目的有本質聯系的、能確切反映器械療效或安全性的指標。次要評價指標是與試驗目的相關的輔助性指標。
2.6對照產品的選擇
對開展臨床試驗的個性化醫療器械,對照產品應當盡可能選擇目前臨床正廣泛使用的、對相應適應癥的療效已被證實并得到公認的等效產品。對照產品的材料、設計、適應癥與試驗產品具有可比性,應當提供對照產品的選擇依據。
2.7統計分析方法
應當明示具體的統計分析方法以及統計分析軟件及版本。數據分析時應當考慮數據的完整性,所有簽署知情同意并使用了受試產品的受試者必須納入分析。數據的剔除或偏移數據的處理必須有科學依據和詳細說明。
臨床試驗的數據分析應當基于不同的分析集,通常包括全分析集(Full Analysis Set,FAS)、符合方案集(Per Protocol Set,PPS)和安全集(Safety Set,SS),研究方案中應當明確各分析集的定義。全分析集中脫落病例,其主要研究終點的缺失值的填補方法等應當在方案中事先予以說明,并進行不同分析策略的靈敏度分析,以評價缺失數據對研究結果穩定性的影響。
主要研究終點指標的分析應當同時在全分析集和符合方案集上進行,安全性指標的分析應當基于安全集。
臨床試驗數據的分析應當采用國內外公認的經典統計分析方法。臨床試驗方案應當明確統計檢驗的類型、檢驗假設、判定療效有臨床意義的界值(非劣效界值)等,界值的確定應當有依據。
對于主要研究終點,統計結果需采用點估計及相應的95%可信區間進行評價。不能僅將p值作為對主要研究終點進行評價的依據。
對驗證期間發生的所有有害事件的種類、嚴重程度、發生頻率及與驗證產品的關系將列表描述。
申請人應當提供基于所有臨床試驗數據的統計分析報告,以便臨床試驗組長單位根據此報告撰寫臨床試驗總結報告。
3.個性化醫療器械根據其內在規律,可以采用臨床評價、動物實驗和功能試驗等方法,進行綜合風險評估。臨床評價可以依據風險要素進行設定,評估對風險要素的控制程度。
(十四)產品的不良事件歷史記錄
應當按要求收集、記錄、提交產品相關的不良事件歷史記錄。
(十五)產品說明書和標簽要求
產品說明書、標簽和包裝標識應當符合《醫療器械說明書和標簽管理規定》要求,還應當符合相關國家標準、行業標準的要求,例如YY/T 0466.1—2016《醫療器械 用于醫療器械標簽、標記和提供信息的符號 第1部分:通用要求》。
除已批準信息外,說明書和標簽中應當明確產品為個性化醫療器械,補充患者特征標識、臨床醫生書面確認產品設計方案的信息或文件編號及其他需要補充的信息。
三、審查關注點
應用本指導原則進行技術審評時,除審查用于骨、關節和口腔硬組織的無源植入性醫療器械產品的安全性和有效性外,還重點關注實現個性化產品設計、完成增材制造加工的能力和質量。
四、編寫單位
本指導原則由國家藥品監督管理局醫療器械技術審評中心編寫并負責解釋。
(責任編輯:admin)


 MGA醫療聯盟:以系統化思
MGA醫療聯盟:以系統化思 國家統計局:中國3D打印設
國家統計局:中國3D打印設 ICC將制定混凝土3D打印墻
ICC將制定混凝土3D打印墻 三項增材制造金屬粉末國家
三項增材制造金屬粉末國家 工信部等新規:工業級3D打
工信部等新規:工業級3D打 2027年產值突破1500億元(
2027年產值突破1500億元( 洞察2023:全球藥
洞察2023:全球藥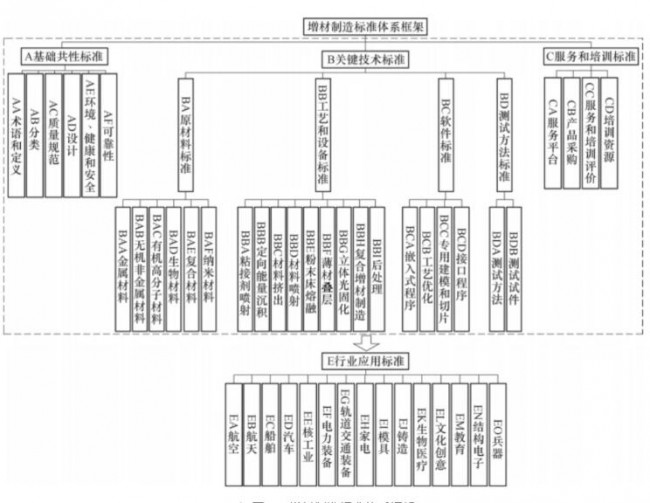 3D打印-增材制造
3D打印-增材制造 《智能制造知識體
《智能制造知識體 2021年中國及31省
2021年中國及31省 全球工程標準協會
全球工程標準協會 毛孔的SLM金屬3D
毛孔的SLM金屬3D

